Prima d'iniziare il trapianto fecale, il proprietario che ha aderito al Progetto Pet FMT preleva un campione di feci del suo cane enteropatico. In circa metà dei casi, il profilo del microbioma mostrerà enterobacteriaceae in quantità superiori alla norma.
Anche nell'uomo, pazienti con IBD hanno un microbioma disbiotico, ricco di enterobacteraceae (1).
In un recente articolo apparso su Nature (2) si spiega la ragione a questo fenomeno.
Le cellule epiteliali intestinali che muoiono rilasciano fattori solubili che stimolano l'espansione delle Enterobacteriaceae e quindi la disbiosi del microbioma intestinale.
Il meccanismo è conservato nei mammiferi e specifico per la morte cellulare per apopotosi.
C'è quindi una relazione tra patologie gastrointestinali, morte cellulare e batteri enterici.
L'apoptosi, o morte cellulare regolata, è parte integrante della vita e ha ampi effetti sullo sviluppo dell'organismo e sull'omeostasi. Malfunzionamenti dell'apoptosi possono manifestarsi in diverse patologie in vari tessuti, tra cui il tratto gastrointestinale.
IBD, infezioni da patogeni alimentari e trattamenti chemioterapici sono accomunati da sintomi gastrointestinali e mostrano aumento di apoptosi.
La ricerca nel dettaglio
In questo articolo gli esperimenti sono articolati e complessi.
Mi limiterò a riassumere i concetti principali e riportare alcuni elementi d'interesse per chi si occupa di enteropatie croniche.
Negli esperimenti sono stati usati tessuto colonico primario di topo, linee cellulari umane e murine, topi convenzionali, topi knock-out e germ-free.
Sono state prese in considerazione diversi tipi di morte cellulare: apoptosi, necroptosi e piroptosi.
Sono stati utilizzati diversi fattori scatenanti dell'apoptosi.
Il succo della ricerca è che le molecole rilasciate dalla cellula di mammifero apoptotica (dipendente dalla caspasi 3 e 7) inducono la crescita di Enterobacteriaceae.
Molto del lavoro è stato fatto su una Salmonella patogena, e si è scoperto che in questa specie la crescita è associata alla trascrizione di alcuni geni, tra cui pflB (pyruvate formate-lyase-encoding pflB gene), identificato come fattore chiave nella colonizzazione batterica.
I meccanismi di colonizzazione di Salmonella sono stati indagati tre contesti:
1. un modello di infezione di origine alimentare,
2. un modello infiammazione intestinale tipo IBD (prosegue sotto)
3. un modello di mucosite indotta da chemioterapia.
In tutti i casi, indipendentemente da come fosse indotta l'apoptosi, il rilascio di molecole solubili e l'attivazione del gene pflB ne determinavano la sovracrescita.
Malattie Infiammatorie Croniche Intestinali
Dato l'incipit dell'articolo, ossia che metà dei cani enteropatici che partecipano al Progetto Pet FMT hanno una sovracrescita di Enterobacteriacee, entriamo nel dettaglio per ciò che concerne malattie infiammatorie croniche intestinali (MICI o IBD).
Da letteratura è noto che esiste una stretta associazione tra disbiosi del micorbioma intestinale e IBD, con sovracrescita di Enterobacteriaceae, e che quest'ultima si lega a sintomi più gravi.
È noto anche che nei pazienti con IBD la citochina TNF è cruciale, perchè promuove l'infiammazione intestinale.
Ultimo tassello è il gene A20, gene di suscettibilità all'IBD, che in condizioni normali frena l'infiammazione indotta da TNF, ma quando mutato o assente non blocca più correttamente l'infiammazione indotta da TNF.
I topi senza questo gene soffrono di aumentata patologia ileale indotta da TNF e apoptosi.
Cosa hanno fatto i ricercatori?
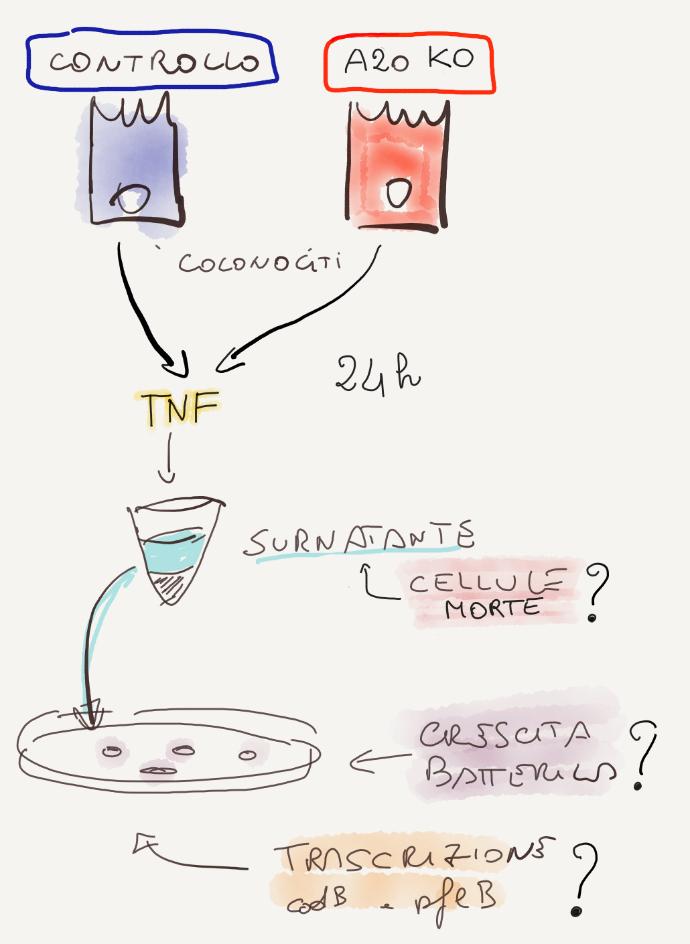
Esperimento 1
Hanno usato cellule dell'epitelio intestinale di topi senza gene A20 (A20 KO), le hanno trattate con TNF per indurre apoptosi, hanno prelevato il surnatante e lo hanno messo nel medium di crescita di Salmonella, E. coli e Kleibsiella.
Hanno valutato la morte dei colonociti, la crescita batterica, i fattori di trascrizione di Salmonella.
Risultati
Rispetto al controllo:
1) le cellule knockout A20 si sono dimostrate suscettibili all'apoptosi guidata dal TNF, e molti più colonociti sono morti a seguito del trattamento,
2) l'apoptosi ha promosso la crescita di Salmonella in vitro,
3) l'apoptosi ha indotto l'espressione del gene pflB in Salmonella,
4) l'apoptosi ha promosso la crescita di Enterobacteriaceae in vitro.
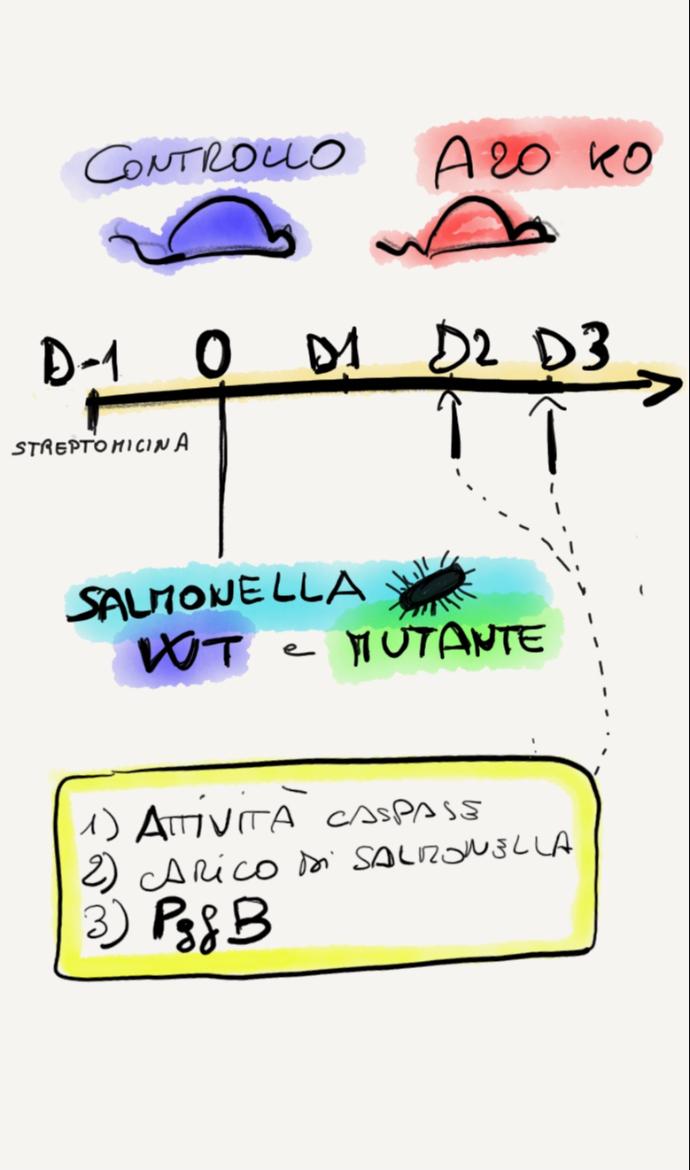
Esperimento 2
Per confermare i risultati, hanno usato topi knockout per il gene A20, trattati con streptomicina per ottenere un modello di colite indotto da Salmonella (3).
Hanno infettato il controllo e il topo knockout con salmonella wild type e con un mutante per il gene pflB, e sono andati a vedere l'attività della caspasi (=apoptosi), il carico di Salmonella (=crescita) e l'espressione del gene PgfB di Salmonella (=fattore determinante la crescita).
Hanno misurato al giorno 1 e al giorno 2.
Risultati
In situazione di colite, rispetto ai controlli:
1) Salmonella induce apoptosi,
2) Salmonella cresce,
3) il gene PgfB viene espresso,
4) tutti i marcatori sono più alti del controllo e aumentano significativamente dal giorno 1 al giorno 2.
In definitiva mutazioni del gene A20 (gene di suscettibilità all'IBD) predispongono ad apopostosi mediata dalla citochina TNF; l'apoptosi alimenta la crescita delle Enterobacteriaceae che a loro volta inducono espressione di TNF, quindi apopotosi, quindi ulteriore liberazione di metaboliti quindi maggiore crescita batterica.
Nota: In Salmonella la crescita è legata all'attivazione del gene PgfB, cosa che non succede in E.coli, a indicare variazioni specie specifica della risposta trascrizionale ai metaboliti dell'apoptosi.
Conclusioni
In generale questi risultati suggeriscono che malattie in cui si ha un aumento dell'apoptosi delle cellule epiteliali intestinali rendono l'ospite più suscettibile alle infezioni esogene e alla disbiosi da sovravrescita di Enterobacteriaceae.
Le cellule in apoptosi infatti rilasciano nutrienti che fungono da carburante per i batteri intestinali.
L'IBD è una malattia caratterizzata da un aumentato livello di apoptosi delle cellule intestinali. La produzione di nutrienti stimola la sovracrescita di Enterobactariaceae che caratterizzano la patologia.
Si aggiunge un tassello di conoscenza ai meccanismi dell'IBD, ma aumenta la complessità dell'interazione ospite-patogeno.
Bibliografia

Barbara Simionati
Laureata in biologia con Master in Business and Management, ho lavorato per molti anni nell'ambito del sequenziamento del DNA e successivamente del microbioma. Ho co-fondato due spin-off dell'Università di Padova: BMR Genomics e EuBiome. Attualmente sono amministratore di EuBiome e docente a contratto presso il Dipartimento di Scienze del Farmaco dell'Università di Padova.

